Sélection et production de VHHs/nanobodies de camélidés
Ce service de PBSIM offre une gamme de compétences allant de la selection de VHHs/nanobodies de camélidés jusqu’à leur production et caractérisation (SPR, BLI, micro-cal).
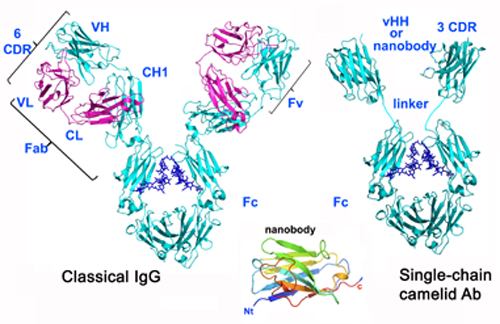
L’utilisation de domaines d’immunoglobulines mono-chaines de camélidés, appelés VHHs ou « nanobodies », a connu une forte croissance au cours des dernières années. L’utilité des nanobodies en biologie structurale est maintenant fermement établie, car ils permettent d’accéder à de nouveaux épitopes dans des régions concaves et à la charnière entre domaines, et de stabiliser les protéines cibles.
Des résultats remarquables ont été obtenus en utilisant les nanobodies avec des protéines multi-domaines flexibles, avec de grands complexes et surtout avec des protéines membranaires telles que des GPCRs, récepteurs divers et canaux. Le groupe de biologie structurale du laboratoire AFMB a été parmi les pionniers à travailler dans le domaine des VHHs/nanobodies.
La plateforme offre un service qui comprend l’immunisation de lamas (Lama glama glama) ou chameaux (Camelus dromedarius) en vue d’obtenir des bibliothèques de cibles spécifiques, le criblage par phage display permet d’obtenir des clones de chaque cible, à partir desquelles plusieurs vHHs/nanobodies sont clonés (service 1), exprimés (service 2) et caractérisés (service 3). Les affinités sont comprises généralement entre 1 et 50 nM (Kd). Notre bibliothèque « naïve » qui regroupe les lymphocytes d’animaux non vaccinés – dans notre cas, 3 chameaux et 4 lamas – peut aussi être utilisée. La randomisation d’un des trois CDRs suivie de criblage conduit à des affinités sub-nanomolaires.
Accessibilité
Académiques et industriels
Coût
A définir pour les industriels en fonction du temps d’utilisation et de l’assistance nécessaires.
Comment faire une demande ?
- Contact : Anaïs Gaubert
Equipement spécifique
- FPLC Äkta Purifier and Xpress (GE Heathcare / Cytiva)
- Microcalorimetry : MicroCal iTC200 (GE Heathcare)
- Microscale thermophoresis : MST Monolith NT.115 (NanoTemper Technologies GmbH)
- Bio-layer interferometry : Octet RED96 system and Blitz system (Pall ForteBio LLC)
- Size exclusion chromatography / multi-angle light scattering / refractometry : HPLC Alliance (Waters) / Minidawn Treos (Wyatt) / Optilab rEX (Wyatt)
Membres
Contacter le groupe
Publications
- Durand E, Nguyen VS, Zoued A, Logger L, Péhau-Arnaudet G, Aschtgen M-S, Spinelli S, Desmyter A, Bardiaux B, Dujeancourt A, Roussel A, Cambillau C, Cascales E, Fronzes R. Biogenesis and structure of the bacterial Type VI secretion membrane core complex. Nature 2015, 300:555-560 [doi: 10.1038/nature14667]
- Nguyen VS, Logger L, Spinelli S, Desmyter A, Le TTH, Kellenberger C, Douzi B, Durand E, Roussel A, Cascales E, Cambillau C. Inhibition of type VI secretion by an anti-TssM llama nanobody, PloS-ONE 2015, 10(3):e0122187. [doi:10.1371/journal.pone.0122187]
- Nguyen VS, Spinelli S, Desmyter A, Le TTH, Kellenberger C, Cascales E, Cambillau C, Roussel A. Production, crystallization and X-ray diffraction analysis of a complex between a fragment of the TssM T6SS protein and a Camelid nanobody, Acta Crystallogr. F 2015, F71:266-271
- Desmyter A, Spinelli S, Roussel A, Cambillau C. Camelid nanobodies: killing two birds with one stone, Curr. Opin. Struct. Biol., 2015, 32C:1–8 [doi: 10.1016/j.sbi.2015.01.001]
- Hassaine G, Deluz C, Grasso L, Wyss R, Tol MB, Hovius R, Graff A, Stahlberg H, Tomizaki T, Desmyter A, Moreau C, Li XD, Poitevin F, Vogel H, Nury H. X-ray structure of the mouse serotonin 5-HT3 receptor. Nature 2014, 512:276-281.